Gezieltes RNA-Editing
ADAR-Produkte von SignalChem
Die ADAR-Familie (Adenosine Deaminase Acting on RNA) umfasst Enzyme, die die Desaminierung von Adenosin (A) zu Inosin (I) innerhalb doppelsträngiger RNA katalysieren, ein Prozess, der als A-zu-I-RNA-Editing bekannt ist und die RNA-Stabilität, das Spleißen und die Translation beeinflusst. ADAR1 wird auch mit verschiedenen Krankheiten wie Typ-I-Interferonopathien, Krebs und Virusinfektionen in Verbindung gebracht, was es zu einem wichtigen Ziel für Medikamente macht. Drei Mitglieder, ADAR1 (p150 und p110), ADAR2 und ADAR3, wurden identifiziert. ADAR1 und ADAR2 besitzen katalytische Aktivität, während ADAR3 wahrscheinlich eine regulatorische Funktion hat. Strukturell enthalten ADAR-Proteine doppelsträngige RNA-Bindungsdomänen und eine Deaminase-Domäne, die Substratspezifität verleihen.
SignalChem Biotech, jetzt Teil von Sino Biological, hat neuartige rekombinante ADAR-Proteine auf den Markt gebracht: ADAR1 (p150), ADAR1 (p110) und ADAR2L (ADARB1). Diese Produkte unterstützen die Forschung zu RNA-Editing-Mechanismen, die Identifizierung von RNA-Zielmolekülen und das Screening potenzieller Modulatoren und Inhibitoren. Darüber hinaus bietet SignalChem Biotech spezielle ADAR-Inhibitor-Screening-Dienstleistungen an, um die Arzneimittelentwicklung in diesem aufstrebenden Bereich zu beschleunigen.
Ausgewählte ADAR-Proteine
|
Human ADAR1 (p150) Protein (Art. N°: SCM-A601-310H) |
Human ADAR1 (p110) (Art. N°: SCM-A611-310GH) |
Human ADARB1 (ADAR2L) Protein (Art. N°: SCM-A602-310F) |
 |
 |
 |
| Die Reinheit von ADAR1 (p150) wurde mittels Densitometrie auf >70 % bestimmt. Berechnetes Molekulargewicht ~155 kDa. Beobachtetes Molekulargewicht ~155 kDa. | Die Reinheit von ADAR1 (p110) wurde mittels Densitometrie auf >70 % bestimmt. Berechnetes Molekulargewicht ~146 kDa. Beobachtetes Molekulargewicht ~138 kDa. | Die Reinheit von ADARB1 (ADAR2L) wurde mittels Densitometrie auf >85 % bestimmt. Berechnetes Molekulargewicht ~85 kDa. Beobachtetes Molekulargewicht ~82 kDa. |
 |
 |
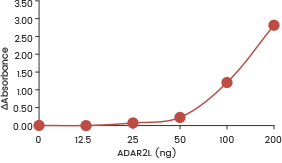 |
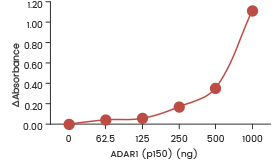
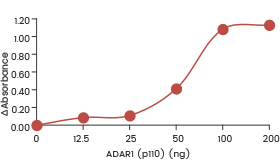
| Rekombinantes humanes ADAR1 (p150) (SCM-A601-310H) zeigt in einem ELISA-Format-Assay eine dosisabhängige Adenosindeaminase-Aktivität gegenüber doppelsträngiger RNA. | Rekombinantes humanes ADAR1 (p110) (SCM-A611-310GH) zeigte in einem ELISA-Assay eine dosisabhängige Adenosindeaminase-Aktivität gegenüber doppelsträngiger RNA. | Rekombinantes humanes ADARB1 (ADAR2L) (SCM-A602-310F) zeigt in einem ELISA-Format-Assay eine dosisabhängige Adenosindeaminase-Aktivität gegenüber doppelsträngiger RNA. |
Einführung in ADAR
ADAR-Enzyme und RNA-Editing
Im Vergleich zum DNA-Editing können beim RNA-Editing die ethischen und sicherheitstechnischen Probleme vermieden werden, die durch die direkte Veränderung der DNA entstehen. Darüber hinaus ist das RNA-Editing reversibel und flexibel, was es zu einem präziseren Ansatz für die Gentherapie macht. Das A-zu-I-Editing ist eine der häufigsten Modifikationen in der RNA und bezieht sich auf die Desaminierung von Adenosin (A) zu Inosin (I) auf einem doppelsträngigen RNA-Substrat (dsRNA). ADAR-Enzyme treiben das A-zu-I-Editing voran und spielen eine zentrale Rolle bei der Regulierung der RNA-Vielfalt, der Aufrechterhaltung der Immunhomöostase und der Unterstützung der Funktion des Nervensystems. ADAR-basierte Therapien entwickeln sich zu einem präzisen Ansatz in der RNA-Bearbeitung und bieten im Vergleich zu DNA-Editing-Methoden wie CRISPR-Cas9 eine höhere Spezifität. In den letzten Jahren hat das ADAR-vermittelte ortsspezifische RNA-Editing großes Potenzial in der Krebstherapie gezeigt, da sie einzelne Nukleotide in Onkogen-Transkripten präzise modifizieren kann, um das Tumorwachstum zu unterdrücken.
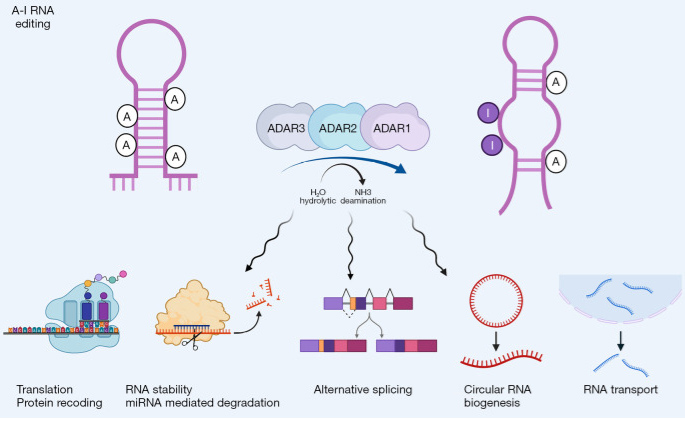
Physiologische und pathologische Funktionen von ADAR
Physiologisch regulieren ADAR1 und ADAR2 das Spleißen, die Stabilität und die Translation von RNA und tragen so zur neuronalen Entwicklung, Hämatopoese und angeborenen Immunhomöostase bei. ADAR1 editiert endogene doppelsträngige RNA, um eine unangemessene Aktivierung der MDA5-vermittelten Interferon-Signalübertragung zu verhindern, während ADAR2 die Neurotransmission durch die Editierung von Ionenkanal-Transkripten wie GRIA2 moduliert. Pathologisch führt der Verlust oder die Mutation von ADAR1 zu übermäßigen Interferonreaktionen und Autoimmunerkrankungen wie dem Aicardi-Goutières-Syndrom, während eine dysregulierte RNA-Bearbeitung das Tumorwachstum, die Metastasierung und die Therapieresistenz bei verschiedenen Krebsarten fördert. Bei Virusinfektionen kann eine veränderte ADAR1-Aktivität entweder die antivirale Immunität unterdrücken oder die Persistenz des Virus begünstigen, was seine komplexe Rolle für Gesundheit und Krankheit unterstreicht.
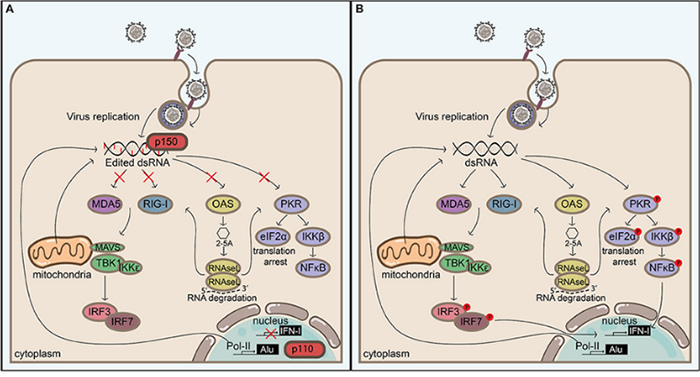
Fortschritte in der Arzneimittelentwicklung mit Fokus auf ADAR
Jüngste klinische Studien, die sich mit ADAR und seinen Inhibitoren befassen, spiegeln die zunehmenden Bemühungen wider, die RNA-Bearbeitung in die Therapie von Krankheiten zu übertragen. Im Bereich Krebs werden niedermolekulare Inhibitoren wie AVA-ADR-703 und CL-AD-100 in präklinischen und geplanten klinischen Studien für Malignome und Immuntherapie-Resistenzen getestet, mit dem Ziel, die durch ADAR1 verursachte Immunumgehung und Arzneimittelresistenz umzukehren. Auf der anderen Seite entwickelt ProQR Therapeutics seine proprietäre Axiomer®-Plattform, die endogene ADAR-Enzyme nutzt, um RNA-Sequenzen präzise zu editieren und so die Korrektur krankheitsverursachender Mutationen bei einer Reihe von genetischen und leberbezogenen Erkrankungen zu ermöglichen. Obwohl es derzeit noch keinen von der FDA zugelassenen ADAR-Inhibitor gibt, werden in laufenden First-in-Human-Studien die Sicherheit, Wirksamkeit und Editierungsspezifität evaluiert, wobei sich die zukünftigen Anwendungsmöglichkeiten wahrscheinlich auf Krebs, Autoimmun- und Viruserkrankungen ausweiten werden.
Screening-Methoden für ADAR-Inhibitoren
Zu den ADAR-Inhibitoren gehören kleine Moleküle, die auf die Zα- oder Deaminase-Domänen abzielen, Antisense-Oligonukleotide (ASO), die die Substratbindung blockieren, und neuartige PROTAC-basierte Degrader, die selektiv das ADAR1-Protein eliminieren sollen. Hochdurchsatz-Screening-Methoden für ADAR-Inhibitoren verwenden in der Regel lumineszente Reporter-Assays in vitro, gentechnisch veränderte Zelllinien oder molekulare Docking-Ansätze, um schnell Verbindungen zu identifizieren, die die ADAR-vermittelte RNA-Editing-Aktivität unterdrücken. Basierend auf dieser innovativen Plattform bietet SignalChem Biotech einen speziellen ADAR-Inhibitor-Screening-Service an, um die Arzneimittelentwicklung zu beschleunigen.
Kontaktieren Sie uns, wenn Sie mehr über diesen Service erfahren möchten.
27.01.2026

Grundlagenforschung
Effektive Transfektionslösungen von Mirus Bio

ChIP-Exo-Seq
Validierte Antikörper von Atlas Antibodies

Analytica 2026
Seien Sie unser Gast!
Metabolismus-Assays
Oxidativer Stress, Glykolyse und Fettstoffwechsel

Neues Jahr, neue Lab...
Bis zu 80 % Rabatt auf Laborware

